Dear iGEMers
This website is operated in collaboration with iGEM Gifu and iGEM Qdai. This article have compiled information about iGEM in Japanese to provide a new information resource for new Japanese iGEMers in the future.
Let's go iGEM Qdai wiki and iGEM Gifu 2021 wiki !
本記事は、iGEM Japan 輪読会にて、iGEM Qdaiによって紹介された、iGEM SZU-China 2019 のプロジェクトについて紹介していきます。

[iGEM Japan 輪読会] テーマ : SZU-China 2019 by iGEM Qdai
目次
テーマ
iGEM SZU-China 2019
RNA干渉技術を用いた除草剤の開発
導入
SZU-Chinaが拠点を置く深圳大学のキャンパス内の雑木林にはMikania micrantha (ツルヒヨドリ) が繁茂しています。ツルヒヨドリは、中南米原産の外来植物で最悪の雑草の一つとされており、生態系に大きな悪影響をを及ぼします。
また、地球温暖化が進行している現在、ツルヒヨドリは分布域の拡大を続けており、今後さらなる被害の拡大が予想されています。
深圳も大きな被害を受けており、深圳島の国有自然保護区の40~60%にツルヒヨドリが生育しています。中国の保護生物であるアカゲザルの生息域でもあるため、生態系の破壊がもたらす影響を危惧されています。
この問題に対処するため、これまで草刈り機を用いた除草、強力な農薬を用いた駆除、昆虫とダニを用いたツルヒヨドリの排除などの対策が行われてきました。しかし、それぞれツルヒヨドリ以外の植物を誤って引き抜いたり、土地を踏み荒らすことによる環境への悪影響、農薬による環境汚染、外来生物による予期しない生態系への影響などの問題点が挙げられます。
これらの対策を踏まえ、SZU-Chinaは、ツルヒヨドリに対する特異性持ち、周囲の環境に与える影響が小さく、安全性の高い駆除方法を開発する必要があると考えました。そこで、RNA干渉の高い特異性と、RNA分子の分解の速さに注目し、RNA干渉技術を用いたツルヒヨドリの除草剤の作成を目標としました。
RNA干渉 (RNAi) とは
研究の概要を説明する前にRNA干渉(RNAi)について簡単に解説します。RNAiに用いるsiRNAは、化学合成されたものを使用する場合と、siRNA発現ベクターで形質転換することにより得られたものを使用する場合に大きく分けられます。SZU-Chinaは形質転換により得られたsiRNAを用いる方法を選びました。
RNAiを担うsiRNAは、ベクターであるdsRNAがダイサーと呼ばれるRNaseⅢファミリーに属する酵素が切断されることで生じる、21から25塩基程度の低分子のRNAです。siRNAは細胞内でアルゴノートと呼ばれるタンパク質と複合体を形成します。
この複合体のことをRNA Induced Silencing Complex (RISC)と呼びます。活性化したRISCはsiRNAの配列をもとに標的mRNAと特異的に結合して分解します。これによって標的遺伝子の発現を抑制します。
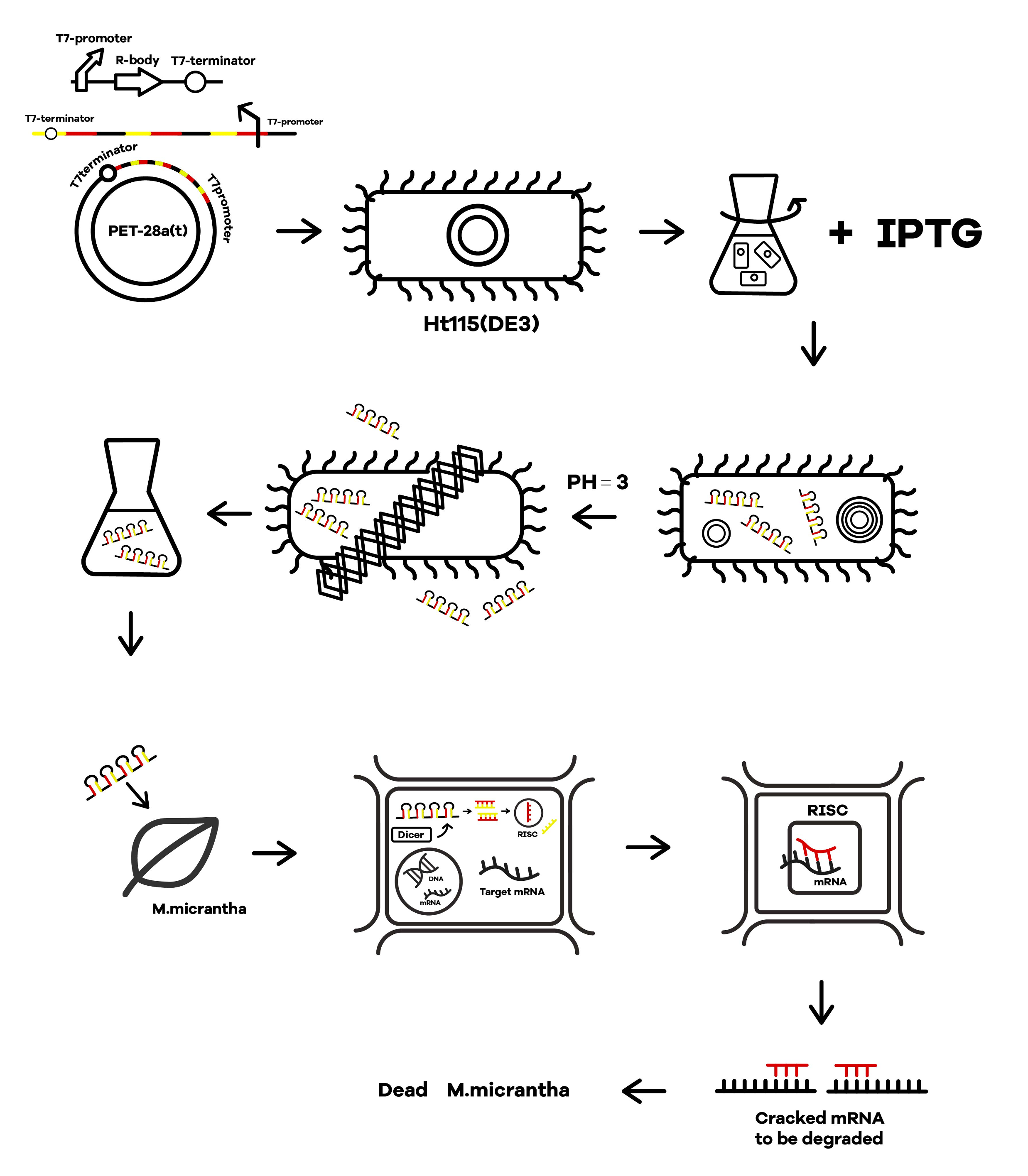
図1 ヘアピンsiRNAの形成概略
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Description
SZU-Chinaでは、このように設計された配列を含むプラスミドで大腸菌を形質転換し、転写されたRNAi分子を抽出することで、除草剤の原料となるsiRNA分子を作成しました。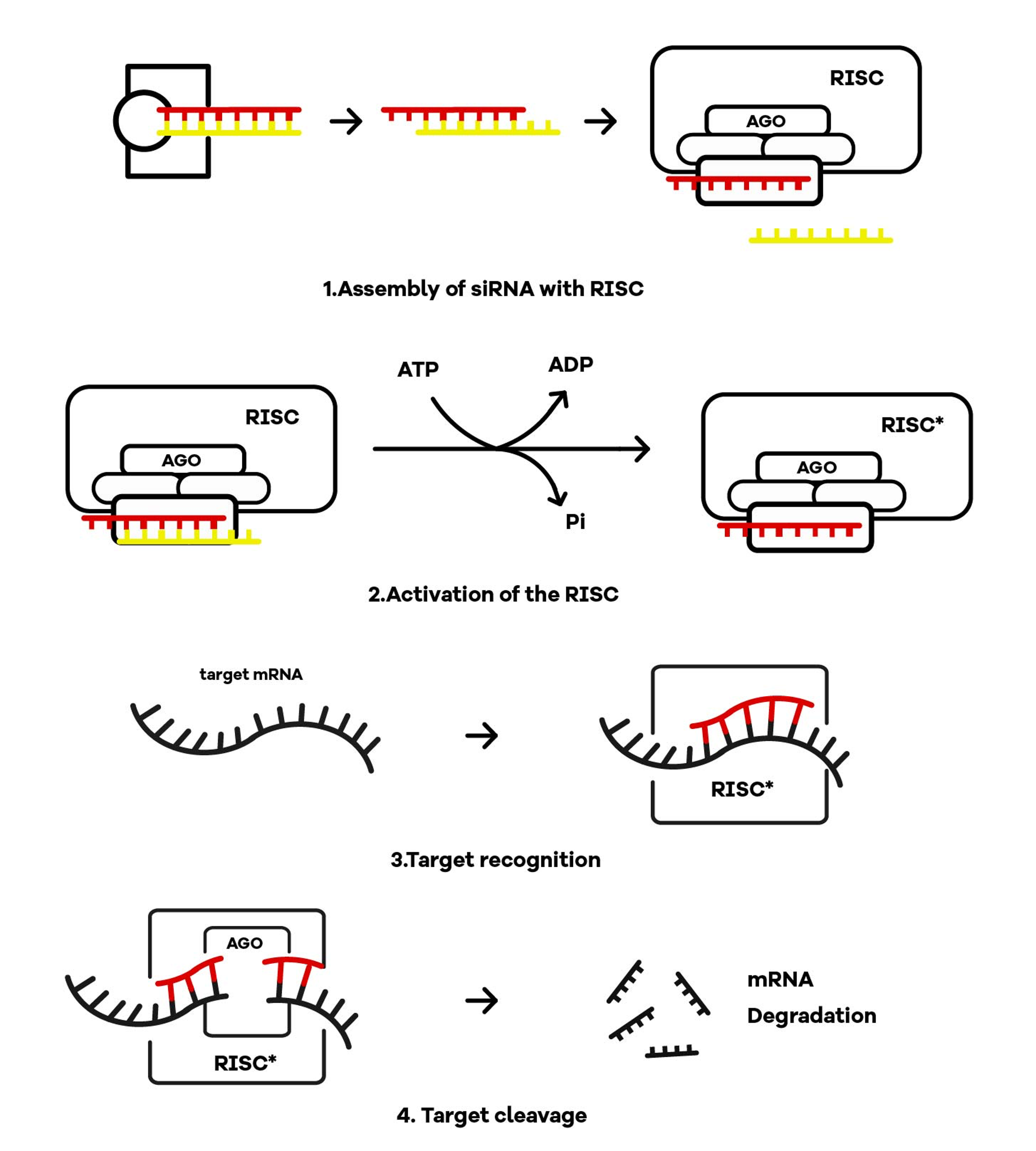
図2 除草剤としての作用機序
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Description
また、さらなるRNAiについての詳細は、東京大学のサイトや、cytivaのサイト を参考にしてください。
参考文献 : 新領域:RNAiの仕組みに1分子観察で迫る ~複合体RISCが標的RNAを素早く正確に切る仕組み~ (u-tokyo.ac.jp)
参考文献 : どうやってノックダウンしますか? - バイオダイレクトメール Technical Tips vol.34 (cytivalifesciences.co.jp
研究の概要
SZU-Chinaチームの最終目標は、RNAi技術を用いたツルヒヨドリの一次代謝遺伝子の発現抑制による除草剤の作成でした。
実験の大まかな流れは以下のようになります。
1. ベクターの選択
2. ベクターの合成
3. 除草効果の有効性の検証
4. セルフクラッキングメカニズムの設計
5. 除草剤「Micrancide」の生産
6. 噴霧方法の検討
1a. RNAi分子の選択
siRNAの合成に用いられたの組み換えpET-28a(+)プラスミドは、ツルヒヨドリから全RNAを抽出し、トランスクリプトーム解析を行うことで発見された特異的なRNAiの配列を用いて設計されました。
RNAi分子をふるい分けるプログラムはチームが独自に設計しました。GitHub (https://github.com/Pinuslin/siRNA_Designer_1.1) にアップロードされています。
作成したプログラムをBLASTによる相同性検索を用いてSZU-Chinaは、ツルヒヨドリの全RNAから最も特異性の高い配列を選択しました。
SZU-ChinaのRNAi技術を用いて除草剤を作成するという取り組みはそれまで前例のないものでした。
そこで彼らは、実際にRNAi技術によってツルヒヨドリの生育を抑制することが出来るか確かめるために最も基礎的な手法であるdsRNA法による確認実験を行いました。
この時のRNAi標的遺伝子は、クエン酸シンテターゼ関連タンパク室をコードしており、高い発現レベルを有する6つの遺伝子でした。
結果、作成したdsRNAをツルヒヨドリに与えたところ、有意に遺伝子発現の抑制ができることが分かりました。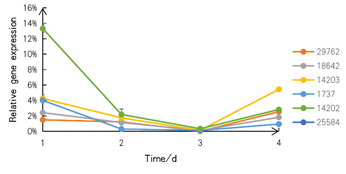
図3 dsRNAによる標的遺伝子発現抑制
https://2019.igem.org/Team:SZU-China/Results
図4 3週間dsRNA処理した葉(下)と対照群(上)
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
1b. RNAiナノ粒子
dsRNA法による検証によりRNAi技術を除草剤作成に応用可能であることが分かりました。一方で、dsRNA方では除草剤に応用できるほど得性が高くなく、また効率性も低いことが分かりました。
そこでSZU-Chinaは別のアプローチとして、ヘアピン構造を持つsiRNA前駆体が複数個集まり形成されたRNAiナノ粒子をベクターとして合成し、植物中に取り込ませることにしました。
合成は3段階に分かれており、一本鎖DNAのリン酸化、一本鎖DNAの環状化、転写によるRNAiナノ粒子の形成から構成されます。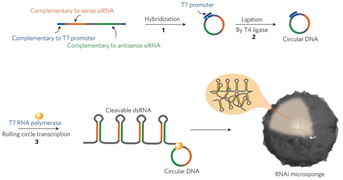
図5 RNAiナノ粒子の形成概略
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
チームは標的遺伝子をdsRNA法の時から変更し、異なる種類のクロロフィル合成関連遺伝子を標的としたsiRNAを設計しました。これにより除草剤の効果を目視で観察出来るようになりました。
表1 クロロフィル合成関連遺伝子を標的としたRNAi分子
新たに設計したRNAiナノ粒子で処理したツルヒヨドリのクロロフィル合成関連遺伝子に対するRT-qPCRを行った結果、標的遺伝子の抑制が十分に抑制されていることが分かりました。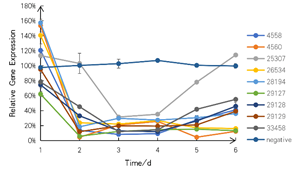
図6 RNAiナノ粒子処理による相対的な遺伝子発現
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
RNAiナノ粒子を散布した葉には白い斑点が生じています。
図7 10日間RNAiナノ粒子処理した葉(下)と対照群
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
2. RNAi分子の合成
SZU-Chinaはナノ粒子をベクターとする除草剤を作成しようとしましたが、ナノ粒子の合成にはコストがかかり、工業的に生産するには採算が取れないとしてこの方法を断念しました。
そして代替案として、shRNAをベクターとする手法による開発を取り組みました。
チームはヘアピン構造の合成の難しさを考慮して4種類の異なるsiRNAの配列が連続してコードされたshRNA設計しました。このshRNAは細胞内に取り込まれると、4つの異なる遺伝子を標的とするsiRNAに分解されるため、効率的に複数の遺伝子を抑制することが出来ます。
この配列を含むプラスミドpET-28a(+)を用いて形質転換したht115(DE3)大腸菌を用いて、shRNAを製造しました。
電気泳動により確認したところshRNAが産生されていることが分かりました。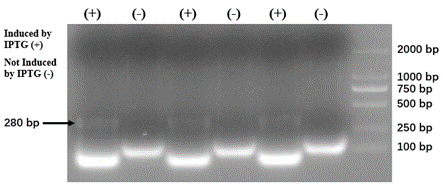
図8 shRNAの電気泳動
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
shRNAの安定性を検証
SZU-ChinaはshRNAの安定性を検証する実験を行いました。保管条件を以下の4つについて、検討しました。
1. 室温条件下で1日
2. 4℃で10日間
3. -20℃で10日間
4. -80℃で10日間
1と2の条件では、shRNAが分解されており、3と4の条件では、分解されていません。この結果からチームは-20℃を保管推奨温度としました。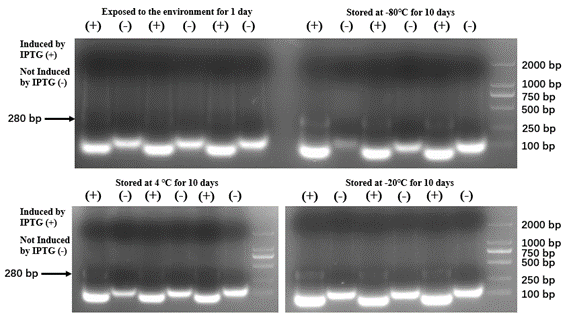
図9 異なる温度条件下でのshRNAの安定性
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
3. 有効性の検証
SZU-Chinaは、葉に取り込まれたsiRNAを検出するため、ノーザンブロットを試みました。Micrancideを噴霧した6日後に試験を行いましたが、siRNAは検出されませんでした。siRNAのサイズが小さすぎたために検出できなかったと考えられます。
図10 ノーザンブロットの結果
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
そこで、新たな方法としてG四重鎖(G-quadruplex-DNA)を用いた検出を試みました。グアニンリッチな鎖は、二重らせんとK+などの1価陽イオンが存在する生理的条件下では、グアニンが4つ並んだG-カルテット(G-quartet)という平面構造を取ることがあります。G-カルテットはさらにπ-πスタッキング相互作用によって重層することでG四重鎖と呼ばれる特殊な高次構造を形成します。
近年の研究によりこのような平面構造を取るG四重鎖は三重鎖や二重鎖、一重鎖のDNAとは異なり、チオフラビンT(ThT)によって非常に高い選択性で認識されることが明らかになりました。ThTはG四重鎖DNAに結合すると蛍光強度が大幅に増加するためシグナルレポーターとして利用することができます。
今回、SZU-Chinaは標的miRNAに完全に相補的かつG-richDNAと部分的に相補的に結合するcDNA鎖を設計しました。このcDNAはmiRNA非存在下ではG-richDNAに結合することでG-richDNAが高次構造を取ることを阻害するため、蛍光が検出されません。
一方で、ターゲットsiRNAが存在する場合は、cDNA/G-richDNA二重鎖から競合して、cDNA/RNAヘテロ二重鎖を形成し、G-richオリゴヌクレオチドを放出することができます。
放出されたG-richオリゴヌクレオチドは、2.0mMのK+存在下でグアニン四重鎖に構造変化し、ThTがこのG-四重らせんDNAを認識して選択的に結合することで、蛍光シグナルが顕著に増強されます。この蛍光強度を測定することで、miRNAの検出が可能になります。(図.11)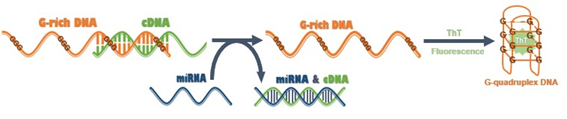
図11 miRNA検出法の概略図
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Measurement
この測定法を利用して測定すると、RT-qPCRの結果から標的遺伝子は、2日間抑制されたのち4日後に回復したことが分かりました。siRNAの量は1日後に劇的に増加し、そこから徐々に減少しました。二つの結果を比較すると整合性が取れており、siRNAが機能していることが分かります。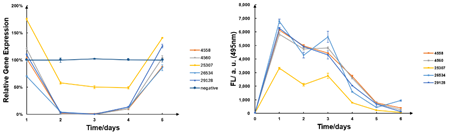
図12 RT-qPCRとsiRNAの結果
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
shRNAを噴霧した後、遺伝子発現を確認したところ、すべての標的遺伝子が2日後に抑制された一方で、対照群は変化しませんでした。RNAiナノ粒子の結果と比較すると、shRNAの遺伝子発現抑制機能はRNAiナノ粒子よりも安定していることが分かりました。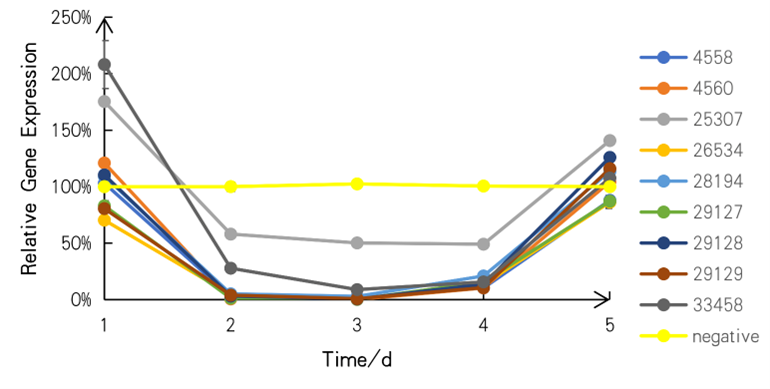
図13shRNAを用いた相対遺伝子発現
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
SZU-ChinaはJiangnan-Chinaチームとコラボレーションし、Jiangnan-Chinaチームが開発したバイオサーファクタント(微生物由来の界面活性剤)がshRNAの効果を促進するか検証を行いました。
shRNAと界面活性剤の溶液を葉に噴霧した場合とshRNAの水溶液を噴霧した場合では、10日間の検証でともに葉がしおれて黒くなりましたが、両者に有意な差は生じませんでした。
図14 10日間shRNAと界面活性剤を噴霧させた葉の形態
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
SZU-Chinaは、10日当たりの葉の変色率をもとにEtiolation-Rate-Modelという統計分析を行い、葉の枯れ具合を評価しました。見かけの変化を定量的に検出するために、葉の色の変化を画像処理によって測定し、緑色と変色した部分の葉面積に対する割合をもとに変色率を算出します。この変色率が80%を超えると葉は枯れたと判断できるとしています。
この測定を行うMatlabscript (https://2019.igem.org/wiki/images/4/40/T--SZU-CHINA--ERSt.txt) は独自にこのチームが開発しました。
shRNA処理した葉が何日後に枯れるのかをこのツールを用いて測定しました。予測は13日後に枯れるとしたところ、結果は15日後に枯れたため、このモデルがある程度信頼性のあるものであることがわかりました。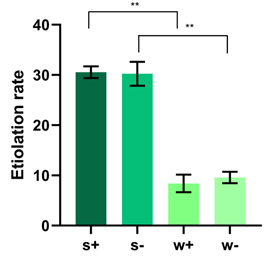
図15 Etiolation Rate Model
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
種特異性の検証
シロイヌナズナとタバコを用いて検証したところ、両者とも枯れることなく、ツルヒヨドリに特異性を示すことがわかりました。
a
b
図16 a)siRNA散布後の Arabidopsis thaliana b)siRNA散布後のNicotiana tabacum L. SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Product
4. セルフクラッキングメカニズム
生物学的封じ込めの観点と、安定したRNAi分子の収量の保証のため、SZU-Chinaは大腸菌に、pH変化により制御されるR-bodyという屈折体という自己破壊機構をプラスミドの中に組み込みました。
これにより、原料の製造過程でpHを酸k制に傾けることで、大腸菌の細胞膜を突き破り内容物を流出させてRNAi分子を得られます。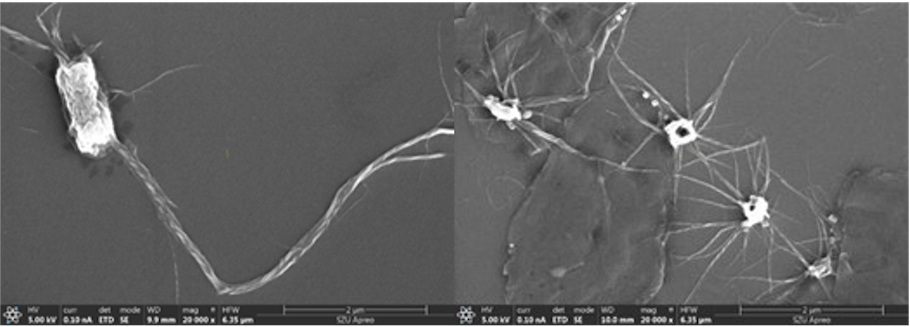
図17 pH=6およびpH=3の時のR-body
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Results
5. Micrancide
以上の検証、除草剤の原料となるshRNAの安定的な生産、shRNAの効果、ツルヒヨドリへの特異的な作用、shRNAの分解までの時間から、環境への負荷が小さく、ツルヒヨドリ以外の植物には外を及ぼさず、また植物の遺伝子発現を永久的に変化させないことにより、安全性は高いとされています。
SZU-Chinaはこの除草剤をツルヒヨドリに対して特異的な除草剤として「Micrancide」と名付けました。Micrancideを用いることで、即効性は低いものの、15日間で確実にツルヒヨドリを枯らすことができます。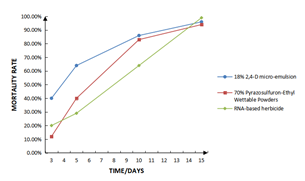
図18 Micrancideおよび他の除草剤との比較
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Product
6. 噴霧方法
SZU-Chinaは、実際の自然環境下での使用を想定して、薬剤の代わりに純水を用いた噴霧試験を行いました。噴霧は、ドローンによる上空からの画像識別と噴霧の判定をソフトウェアで制御して行います。
屋内試験では、ツルヒヨドリとシロイヌナズナを正確に区別して除草剤を噴霧しました。屋外試験では、より複雑な植物種が生育する環境下でドローンを飛ばしましたが高い精度で噴霧することが可能であることを示しました。
今後は農業用ドローンと組み合わせた大規模な除草や、山間部などの人の手による作業が困難な場所での利用を想定しています。
まとめ
SZU-Chinaは、iGEMプロジェクトを通して作成したMicrancideを生産、販売、普及させることを次の目標に定めています。実際にMicrancide用のボトルとケース、原料の合成キットを作成しています。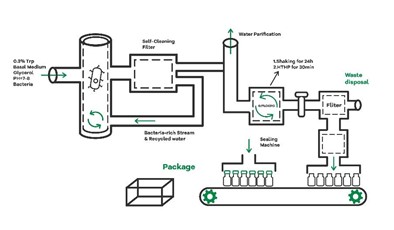
図19 Micrancide除草剤製造の概略
SZU-China 2019, 2019, Micrancide Fight GREEN for More Green, https://2019.igem.org/Team:SZU-China/Prospect
さらに社会の環境に対する意識の高揚、市場の確保など、実用化に向けた活動を続けています。その一環として「GREEN Hunter」というアプリを開発しました。このアプリはWeChatのプラットファームに対応しており、中国国内でのツルヒヨドリへの関心を高める狙いです。
日本においても、ツルヒヨドリは沖縄県などの地域で生息していることが確認されており、特定外来生物として駆除の対象になっています。生態系の維持と景観の保全を行うための手段としてMicrancideを活用することができれば、環境への被害を最小限に抑えて対処することが出来るでしょう。
しかし、RNA干渉技術を用いた除草剤に関して一般の理解を得ることは難しいことが予想され、丁寧な説明が必要になると考えられます。安全性の確保と環境への影響をさらに吟味して、広く理解を得られるような手立てを今後も続けることができれば、世界中の生態系の保全に有用な除草剤になると予想されます。
SZU-China 2019は、ラボレベルの実験を実用段階に進め、流通や生産に関しても合理的な方法を模索することで、iGEMの枠にとらわれない活動を進めることに成功しました。より実用的で社会に影響力のあるプロジェクトの設定方法や活動の進め方に関して、今後のiGEMerのよい参考になると思いますので、ぜひ一度Wikiをご覧になってみてください。