iGEM Japan 2022 輪読会 #10では、「安全な除去ルートを割り出す地雷探知装置を合成生物学を応用して作る」をテーマに、以下の2つのプロジェクトが紹介されました。
・NEFU-China2020 BOLD
・Bielefeld-CeBiTec2021 P.L.A.N.T.
本記事では、2つ目のプロジェクトである、Bielefeld-CeBiTec2021について紹介していきます。
このプロジェクトは、レポーターシステムを取り入れた植物ベースの検出システムを利用して、広範囲における化学兵器の検出を試みるプロジェクトです。

「安全な除去ルートを割り出す地雷探知装置を合成生物学を応用して作る」(Bielefeld-CeBiTec 2021 P.L.A.N.T.) - iGEM Japan 2022 定例会 (輪読会) #10-2
はじめに
現在、世界大戦によってドイツやフランスをはじめとする多くの国に残された化学兵器やその分解生成物が問題視されています。しかし、土壌中に残されたこれらの化学兵器の位置は正確に把握されておらず、それらの検出及び除染には莫大な費用と労力がかかります。
また、残存が既知の地域と疑いのある地域において検知・除染が完了するまでには、費用のみならず莫大な時間を要します。しかし、その間に化学兵器内から化学物質が土壌中に漏れる可能性があり、非常に危険であるため早急に検出・除染を行わなくてはなりません。
現在、化学兵器前駆体や分解生成物を広範囲において検出が行えるようなシステムは確立されておらず、疑わしい地域を含めた世界中の国々に残された全ての化学兵器を早急に発見することは困難です。
そこでこのチームはレポーターシステムを取り入れた植物ベースの検出システムを利用して、広範囲における化学兵器の検出を試みました。
検出システムの概要
以下のような過程により、植物によって化学兵器の検出を行いました。
①化学兵器に含まれる化学物質に関連しつつも比較的安全な化学物質を選択し、植物に吸収させる
②化学物質が受容体に結合し認識されると、植物に導入されたレポーター遺伝子が発現し、赤色色素が生成される
③植物の葉が赤く変色することにより、化学物質を検出する
ここからは、上記のシステム作成のために行った研究の内容を大きく次の4つに分けて説明していきます。
①植物への化学物質の添加
②大腸菌でのシグナル伝達カスケードの確立
③RUBYレポーターとシグナル伝達カスケードのテスト
④肉眼で検出可能なレポーターシステムの作成と最適化
①植物の化学物質吸収
まず、植物が検出したい化学物質に対して耐性を持つのか、またどれくらいの化学物質を吸収するのかを調べました。今回使用した植物は、Nicotiana benthamianaというたばこ植物です。一過性に形質転換できるという性質があります。
化学物質に選択した化学物質を添加し観察したところ、植物に対する化学物質の毒性は確認されませんでした。
また、GC/MS分析(ガスクロマトグラフィー/質量分析)を用いて吸収量を測定した結果、TDG、MPA、BTCAが植物に取り込まれ、栽培から1日後はもちろん9日後でも検出されることが分かりました。(DIMP、DEEPは抽出不可により、吸収量の分析は行えませんでした。)
②大腸菌でのシグナル伝達カスケードの確立
次に、化学物質を検出するために必要となるシグナル伝達カスケードを大腸菌でおいて確立しました。
⑴カスケードの構築
シグナル伝達カスケードの構築には大腸菌の走化性の機構を利用しました。走化性には、リガンド、ペリプラスムに存在する特定の受容体、PBP(ペリプラスム結合タンパク質)が必要になります。今回は、リガンドにBTCA、特定の受容体にはTrg受容体、タンパク質にはRBPを使用しました。
今回利用するカスケードは右図のような流れで進みます。まず、リガンドであるBTCAがTrg受容体に結合し、そこに付加したRBPがプロモーターを活性化させます。このプロモーターは、緑色蛍光タンパク質GFPの発現を制御します。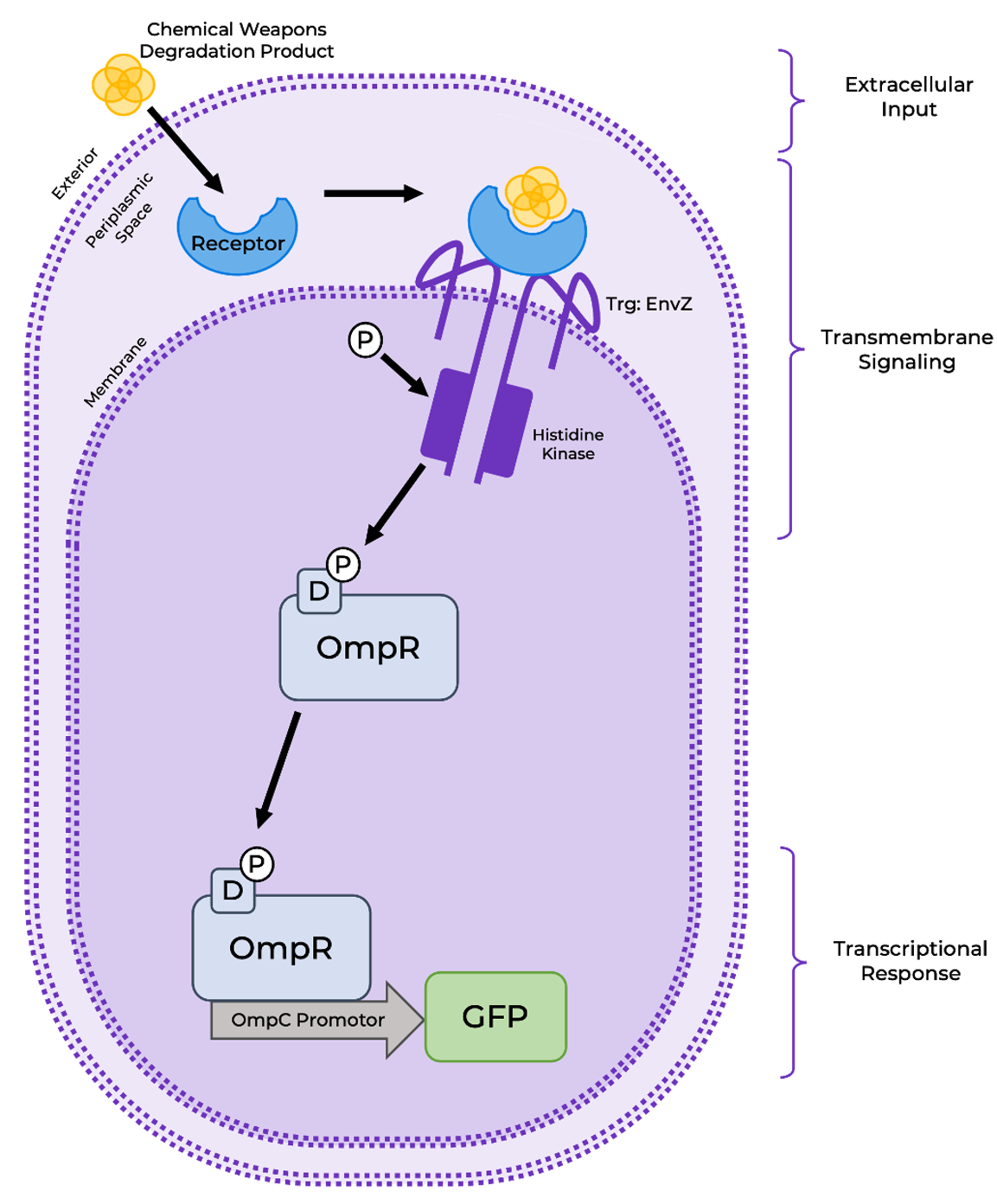
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Bacteriaより引用
⑵使用したプラスミド
今回は、こちらのアラビノース誘導性のプラスミドを選択しました。このプラスミドはカスケードに必要となるTNT受容体の発現を制御するプロモーターを含みます。
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Bacteriaより引用
⑶内在性RBPはカスケードの活性化に十分か
最初に、受容体に付加してプロモーターを活性化するRBPが大腸菌に含まれている分で十分であるのか確かめました。様々な組み合わせで誘導を試みた結果、アラビノースとリボースによる誘導が最も高い蛍光を示しました。また、全体的に蛍光が低くなったことから内在性のRBPはカスケードの活性化に不十分であると考えられます。
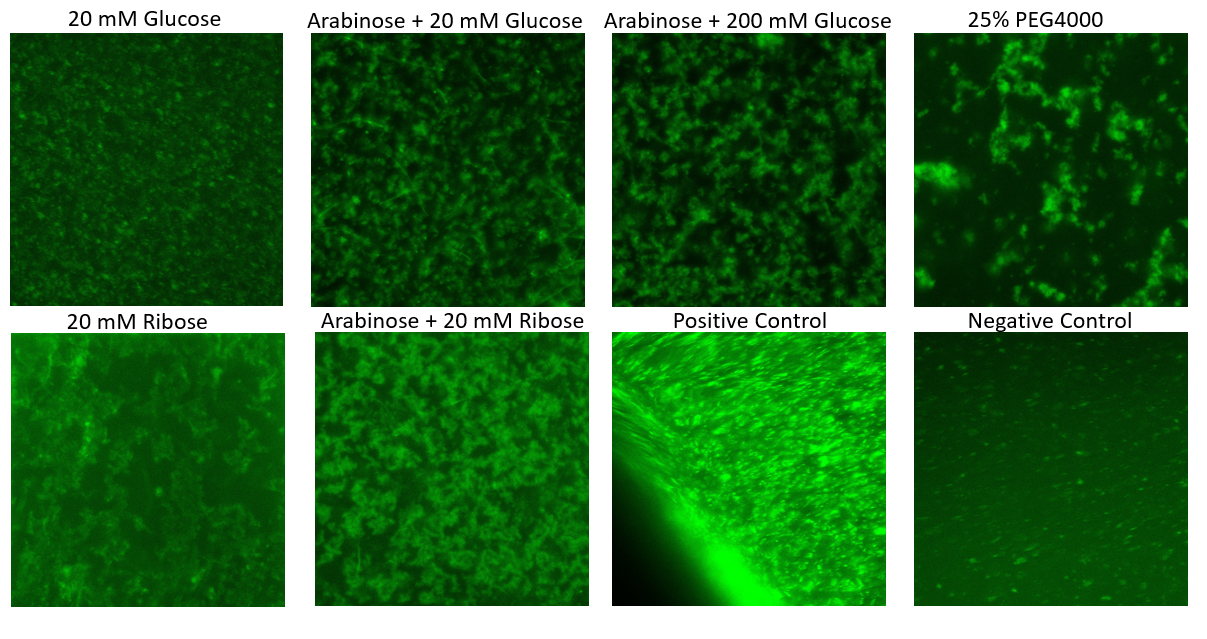
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Bacteriaより引用
⑷RBPの過剰発現
⑶の実験で蛍光が全体的に低いのは、内在性のRBP発現が低いからではないかと考え、RBPを過剰発現させれば蛍光が増加するのかを調べました。
結果は右のグラフのようになり、RBPを過剰発現させると、させていない場合よりも高い蛍光を示しました。このことから内在性のRBPはカスケードにおける鍵であるといえます。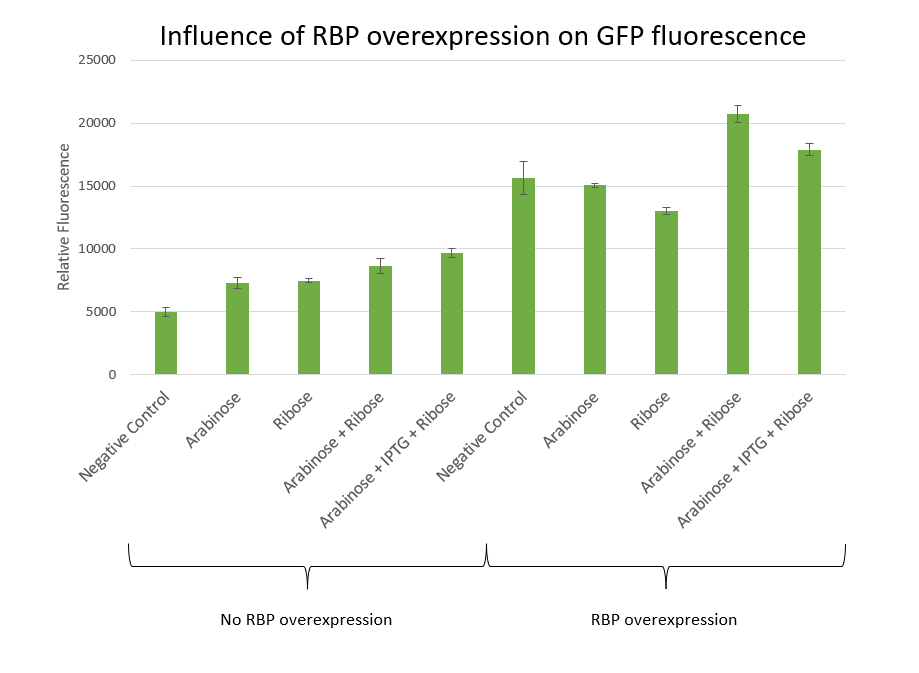
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Bacteriaより引用
⑸BTCA受容体の過剰発現
次に、計算的に設計されたBTCA受容体の過剰発現を行いました。様々な組み合わせで蛍光を測定した結果右のグラフから分かるように、リガンドであるBTCAとカスケードの誘導に必要なアラビノースの両方が添加されたときに最も高い蛍光を示すことが分かりました。BTCA、アラビノースそれぞれを片方のみ添加した場合には蛍光が増加しなかったことから、カスケードが蛍光レベルの上昇に寄与しているといえます。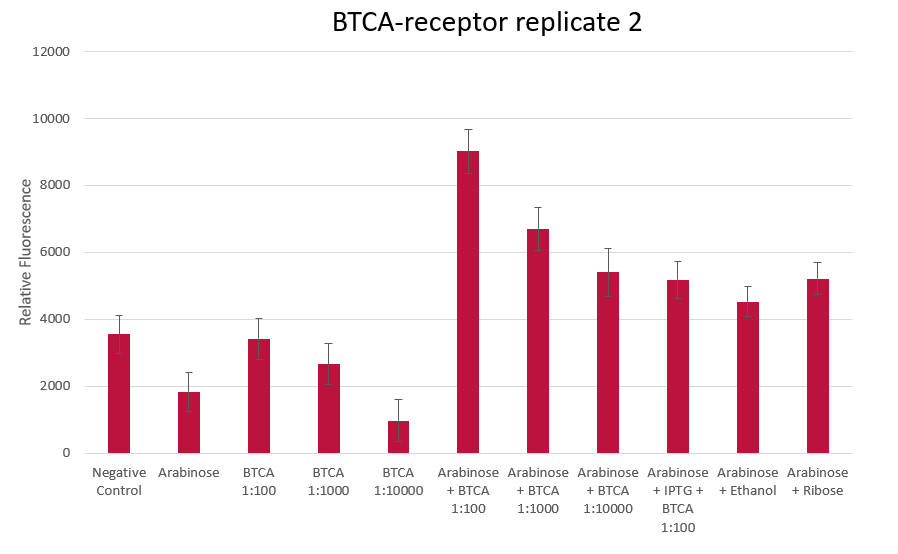
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Bacteriaより引用
⑹BTCA受容体とRBPのリガンド結合効率の比較
BTCA受容体発現株ととRBP発現株において、様々な組み合わせで蛍光を測定した結果、BTCA受容体結合BTCAは、RBP結合BTCAと比べて約2倍も高い蛍光強度を示すことが分かりました。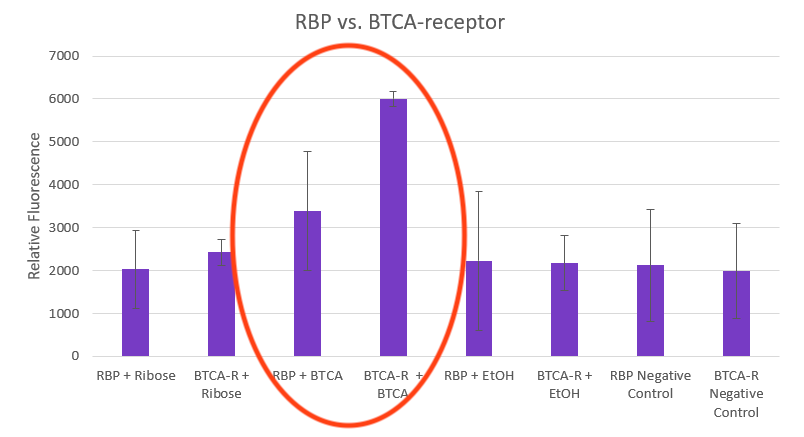
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Bacteriaより引用
⑺BTCA受容体の機能の確認
BTCA受容体BTCAとネガティブコントロールを使用して蛍光強度を測定したところ、BTCA受容体培養物のみGFPが発現し、蛍光が見られることが確認できました。このことから、GFPの蛍光はカスケードによるものであるといえます。
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Bacteriaより引用
⑻化学物質の大腸菌への毒性試験
大腸菌が選択した化学物質に対しどのくらいの耐性を持つのかを調べました。この結果、大腸菌が増殖可能である限界の濃度がそれぞれの化学物質において分かりました。また、一部の化学物質は大腸菌によって代謝されるため、培地中の濃度変化を考慮する必要があることが分かりました。
③RUBYレポーターとシグナル伝達カスケードのテスト
この章では、アグロインフィルトレーションを用いて植物のシグナル伝達カスケードとRUBYレポーターのシステム機能性をテストした。
まず、植物を形質転換する最も一般的な方法として、アグロインフィルトレーションが選ばれている。アグロインフィルトレーションとは、植物の安定した形質転換と比較して、速くスクリーニングするための方法である。
今回の研究で化学物質の検出に用いたのがRUBY Reporter である。RUBY Reporter の機能を植物で検証するために、アグロインフィルトレーションを用いて植物に浸潤させた。その結果、右図のようにRUBYが発現し、機能することが分かる。そのため、RUBY は植物におけるレポーターとして適していると言える。
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Tobacco より引用
②では大腸菌内でBTCAを検出する機構を作った。そのときでは、GFPをレポーターとしてもちいたが、実際にはRUBYレポーターを使用する。よって、RUBYレポーターを導入したプラスミドを作成した。また、プラスミドの情報量が多すぎるために分割構築をして、後で1つに合成できるようにした。
シグナル伝達カスケードを2つのプラスミドに分配するためには、植物に2つのプラスミドを形質転換する必要があるため、アグロインフィルトレーションを用いた共形質転換が可能かどうかを検証した。RUBY レポータープラスミドで植物を形質転換しました結果、顕微鏡により、RUBYが浸潤したスポットに発現していることを証明することができた。よって、シグナル伝達カスケードを2つのプラスミドに分配可能であることが示された。
これまでの章から、TNT代替物質BTCAが植物に取り込まれ、検出できることが示された。よって、BTCAはカスケードの機能テストに適した物質であると思われたため、実際にBTCAを含む植物を水耕栽培して実証実験を行った。結果は予想に反して、試験植物の葉は赤くならず、カスケードがうまく機能しなかった。ただし、これまでの実験によって、計算機で設計したBTCA受容体がバクテリアで機能することは証明できたので、植物でもテストすることができる。
④新たなレポーターシステムの作成と最適化
この章では現在のレポーターシステムは屋外での使用に向いていないことが問題だった。そこで、屋外でも使用できるように肉眼で簡単に検出できるレポーターシステムの作成を目指した。
そのレポーターシステムがRUBYとANTHOSです。RUBYは赤色の色素ベタレインを合成するための3つの酵素を1つにまとめたものである。ただし、今回使用する植物にはベタレインの合成能力がない。一方で、ANTHOSは今回実験する植物の葉に存在する天然アントシアニンの合成を活性化する3つの転写因子から構成されている。結果を先に述べると、一過性に形質転換させた結果、RUBYレポーターだけが赤色色素の生産に成功した。
(1)RUBY
RUBYレポーターの特性を評価するために、植物の葉に、RUBYを一過性に形質転換させた。その結果、右図のように葉の色が赤色に変化し、2日後にはRUBYがはっきりと認識できる。さらに、9週間後でもRUBYがはっきり認識できており植物の葉にRUBYは長期間安定に存在することが分かった。
この色の変化について、いくつかの種類の解析をしたので紹介する。

※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Reporter より引用
植物の葉からベタレインを抽出して定量したものが左上のグラフになる。このグラフはRUBYが作ったベタレインの合成量が示されている。前のスライドつづいてRUBYは長期間安定に存在することが数値的に確認できた。アグロインフィルトレーション後の2つの異なる時点での転写物を解析したものがこちらのグラフです。このグラフからは、3 種類の RUBY 酵素はすべて発現したことが確認できた。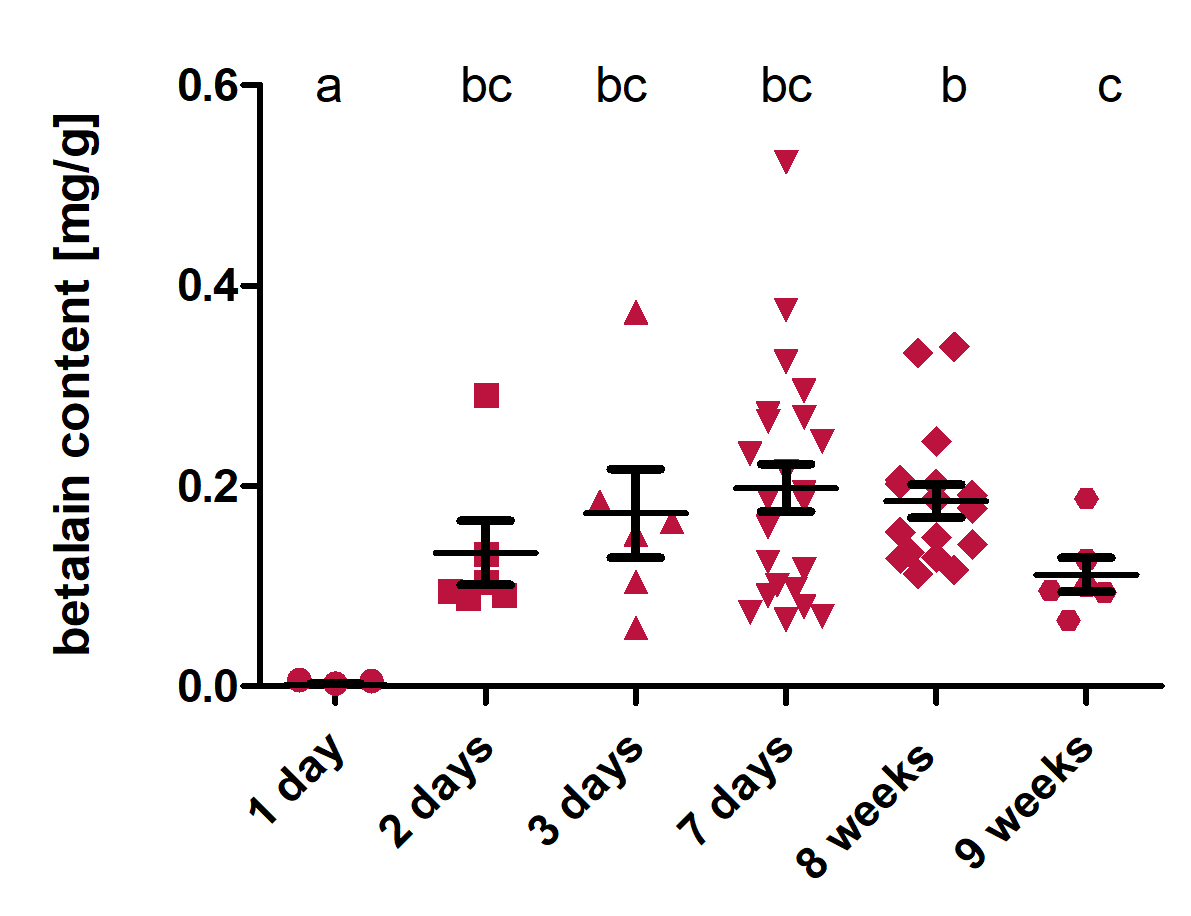
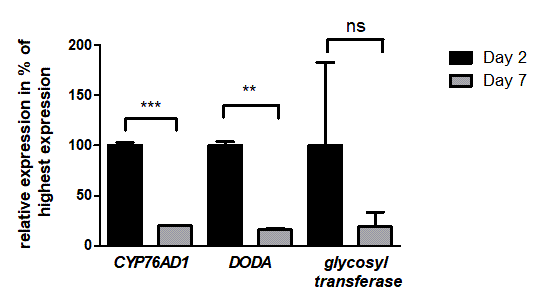
※画像はhttps://2021.igem.org/Team:Bielefeld-CeBiTec/Reporter より引用
また、RUBYの発現が光合成に悪影響を及ぼさないかどうかを確認するためにクロロフィル蛍光の測定を行いました。クロロフィル蛍光の測定は、光合成の複雑な制御を調査・解明するための強力なツールです。ここで、非光化学消光NPQとは、吸収した光エネルギーを無害に変換して過剰な励起エネルギーを消散させるプロセスが強化されることを言う。測定の結果、RUBYレポーターの発現は通常の光条件下での光合成を損なわないことが分かった。ただ、RUBYレポーターの発現は、高い光強度に対応する葉の能力を損なわせているが、それと同時に、RUBYの発現は、光強度の増加とともにNPQの増加をもたらしていることが分かった。
(2)ANTHOS
ここで、ANTHOSの話題に移る。植物がもともともっているアントシアニンの合成を活性化するのがANTHOSの目標となっています。アントシアニンの生成の活性化にはMBW複合体が必要となります。MBW複合体はR2R3MYB転写因子、bHLH転写因子、WD Repeat Proteinの3つの物質から構成されています。先ほど述べた実験では、ANTHOSは色素を発現しなかったので、ANTHOSを機能させるにはどの転写因子を組み合わせて発現させればよいかということを専門家との助言を得て実験中となっている。
まとめ
① 植物が化学物質を吸収して、その検出に成功した。
② TNT代用物質BTCAを検出するためのシグナル伝達カスケードを大腸菌における確立して、ベースとなった受容体よりも特異的にリガンドと結合する受容体を計算的に設計することに成功した。
③ シグナル伝達カスケードのテストは、TNTと化学構造が似ていることから、BTCAを受容体リガンドとして使用し、RUBY は植物におけるレポーターとして機能することを確認した。また、プラスミドにRUBYを導入して、カスケードの分割構築に成功し、計算機で作成されたBTCA受容体がバクテリアで機能することを確認した。
④ RUBYレポーターは一過性形質転換により植物に導入することに成功しました。RUBYの発現を活性化することで、赤色色素の生産も確認することができ、その色素は植物の葉に長期間安定に存在することを確認した。
※今回使用した画像は全てBielefeld-CeBiTec2021のwiki のResultから引用しています。(引用日 2022.3.26)